### Tóm tắt
Ở điều kiện bình thường nước là một chất lỏng bởi giữa các phân tử nước có liên kết hydrogen giữa nguyên tử H của phân tử này với nguyên tử O ở phân tử khác. Liên kết xuất hiện đủ mạnh nhờ hai yếu tố: (1) sự khác biệt về độ âm điện giữa H và O; (2) sự bất đối xứng của phân tử nước. Sự bất đối xứng đến từ lai hoá sp$^3$ của nguyên tử O làm cho hai liên kết của O tạo thành một góc 104,5$^\circ$ từ đó phân tử nước trở thành một lưỡng cực điện. Lưỡng cực điện hút nhau đủ mạnh để nước là chất lỏng.
### 1. Đặt vấn đề
Ở điều kiện nhiệt độ và áp suất bình thường, nước ở dạng lỏng. Tuy nhiên, tại sao nước lại là chất lỏng trong khi các chất khác như O$_2$, N$_2$, CO$_2$ lại là chất khí. Câu trả lời thường gặp là giữa chúng tồn tại liên kết hydrogen. Liên kết hydrogen giữa các phân tử nước đủ lớn làm cho chuyển động nhiệt không thể tách rời cách phân tử nước ra khỏi nhau như nước ở trạng thái khí. Tuy nhiên, tại sao lại có liên kết hydro giữa các phân tử nước?
### 2. Độ âm điện
Liên kết hydrogen là lực hút tĩnh điện xảy ra giữa nguyên tử hydrogen của một phân tử A với một trong các nguyên tử có độ âm điện cao như oxygen, nitrogen, hoặc fluorine của phân tử B. Do độ âm điện của H là 2,2 (thang đo Pauling) thấp hơn C (2,55), N (3,04), O (3,44), F (3,98) nên trong các liên kết cộng hoá trị với các nguyên tố này, H có độ phân cực dương $\delta^+$ còn các nguyên tố trên có độ phân cực âm $\delta^-$.
Độ âm điện là một khái niệm mô tả khả năng của một nguyên tử trong một phân tử thu hút các điện tử về phía nó. Khi nguyên tử H của phân tử A lại gần một trong ba nguyên tử N, O, F của phân tử B thì phân cực dương sẽ hút phân cực âm làm cho phân tử A hút phân tử B. Tương tác giữa A và B như vậy gọi là liên kết hydrogen. Ví dụ cho liên kết này là liên kết giữa H của nước với phân tử O$_2$ làm cho phân tử oxygen có thể hoà tan trong nước nhờ đó các loài cá có thể sử dụng. Tuy nhiên liên kết đó không mạnh nên chỉ một lượng khoảng 8 mg oxygen hoà tan tối đa trong một lít nước ở điều kiện bình thường.
Liên kết hydrogen không phải là liên kết hoá học hiểu theo nghĩa có sự trao đổi điện tử giữa các nguyên tử như liên kết cộng hoá trị, liên kết ion hoặc liên kết kim loại. Nó là một loại tương tác phân tử giống như tương tác van der Waals nhưng mạnh hơn.
Để giải thích liên kết hydrogen giữa các phân tử nước chúng ta không chỉ cần đến sự khác biệt về độ âm điện mà cần thêm một tính chất khác. Đó là sự bất đối xứng của phân tử nước. Sự bất đối xứng này đến từ một khái niệm trong hoá học lượng tử: lai hoá sp$^3$.
### 3. Lai hoá sp$^3$
Để hiểu lai hoá sp$^3$ hãy bắt đầu từ nguyên tử C với cấu hình điện tử ở trạng thái cơ bản là 1s$^2$ 2s$^2$ 2p$^2$. Hai điện tử trong cùng 1s$^2$ không tham gia các phản ứng hoá học thông thường nên bỏ qua. Năng lượng của 2s và 2p chênh lệch nhau rất nhỏ (trong nguyên tử hydrogen, hai mức năng lượng này bằng nhau, tức là bị suy biến). Chuyển động nhiệt có thể làm một điện tử ở trạng thái 2s chuyển sang trạng thái 2p theo sơ đồ 2s$^2$ 2p$^2$ trở thành 2s$^1$ 2p$^3$.
Đến đây sự lai hoá xảy ra. Theo nhà hoá học đạt giải Nobel năm 1954 L. Pauling, bốn điện tử ở cấu hình 2s$^1$ 2p$^3$ sẽ lai hoá với nhau để trở thành một loại trạng thái mới hoàn toàn mà ông đặt tên là s$^1$p$^3$, viết gọn thành sp$^3$. Bốn bốn trạng thái này có năng lượng giống nhau và hình dạng của orbital cũng giống nhau. Orbital sp$^3$ sẽ có 25% giống 2s và 75% giống 2p.
Vì sp$^3$ giống 2p nhiều hơn nên hình dạng của orbital lai hoá sẽ giống orbital 2p. Chúng ta biết rằng 2s có hình cầu, 2p có hình chuỳ nên orbial lai hoá có hình chuỳ. Bốn hình chuỳ của orbital sp$^3$ hướng về 4 phía đối xứng trong không gian 3 chiều tạo nên một tứ diện đều mà hạt nhân nằm ở tâm còn 4 đỉnh là 4 thành phần của orbital (Hình 1). Tứ diện đều của orbital lai hoá giải thích hình dáng của phân thử methane CH$_4$: C ở giữa, 4 nguyên tử H nằm ở 4 đỉnh.

Hình 1: Phân bố không gian của orbital lai hoá sp$^3$ của nguyên tử C. Góc giữa hai thành phần của orbial là 109,5$^\circ$.
Nguyên tử O có có cấu hình điện tử ở trạng thái cơ bản là 1s$^2$ 2s$^2$ 2p$^4$, nhiều hơn C hai điện tử. Hai điện tử đó sẽ chiếm hai trong bốn thành phần của orbital lai hoá bởi mỗi thành phần có thể có tối đa hai điện tử.
Trong bốn đỉnh của tứ diện đều, hai đỉnh bị chiếm đầy còn hai đỉnh độc thân có thể tạo liên kết hoá học (Hình 2). Đó chính là hai đỉnh tương ứng với hoá trị O$^{2-}$ của oxygen. Góc giữa hai đỉnh bị thay đổi chút ít trở thành 104,5$^\circ$, tạo nên sự bất đối xứng của phân tử nước khi hai đỉnh này liên kết với H.
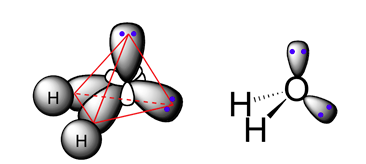
Hình 2: Phân bố không gian của orbital lai hoá sp$^3$ của nguyên tử O. Hai đỉnh tứ diện bị chiếm bởi hai điện tử làm O chỉ còn 2 thành phần orbital độc thân, O có hoá trị 2 trong các phản ứng hoá học. Góc giữa hai thành phần của orbial là 104,5$^\circ$.
### 4. Tính chất của nước
Do chênh lệch về độ âm điện giữa H và O làm cho phân tử nước có phân cực âm ở nguyên tử O $\delta^-$ và phân cực dương ở H $\delta^+$. Do đó phân tử nước tạo thành một lưỡng cực điện. Lưỡng cực điện sẽ hút nhau làm nên liên kết hydrogen của phân tử nước (Hình 3).
Năng lượng liên kết giữa O và H lớn, khoảng 20 kJ/mol. Động năng cần thiết đề phá với liên kết trên tương đương với nhiệt độ 100$^\circ$C ở điều kiện bình thường. Đó chính là nhiệt độ sôi của chất lỏng này. Nhiệt độ sôi là nhiệt độ tại đó chuyển động nhiệt của các phân tử thắng được lực liên kết giữa chúng. Nhiệt độ sôi càng cao thì lực liên kết càng lớn.
Liên kết hydrogen làm cho nước là chất lỏng ở nhiệt độ từ 0 đến 100$^\circ$C. Ở trạng thái lỏng, các phân tử vẫn có thể di chuyển. Mỗi khi phân tử di chuyển đến một vị trí mới, nó lại liên kết với các phân tử khác. Khi nhiệt độ thấp hơn 0$^\circ$C chuyển động nhiệt quá nhỏ làm cho phân từ hầu như không di chuyển mà dao động xung quanh một vị trí nào đó, đó là lúc nước bị đóng băng.
Mặc dù góc liên kết nội tại của phân tử nước là 104.5$^\circ$, khi đóng băng sự sắp xếp trong không gian ba chiều của nhiều phân tử nước tạo ra một mạng lưới có các góc gần với 120$^\circ$ nên bông tuyết có hình lục giác.

Hình 3: Liên kết hydrogen giữa các phân tử nước đến từ phân cực $\delta^-$ của nguyên tử O và $\delta^+$ của nguyên tử H.
### 5. Phân tử CO$_2$ không bị phân cực
Với góc liên kết như vậy thì tại sao phân tử CO$_2$ lại không bị phân cực? Đó là bởi hai nguyên tử O phân bố đối ứng hai bên nguyên tử C. Sự đối xứng đó làm cho phân tử này không trở thành một lưỡng cực điện. Điều đó làm cho tương tác giữa hai phân tử CO$_2$ không có tương tác lưỡng cực nên nó là chất khí ở nhiệt độ phòng. Tương tự như vậy, các phân tử O$_2$, N$_2$... cũng là các chất khí.

Hình 4: Cấu trúc phân tử CO$_2$ và H$_2$O. Đối xứng của O hai bên C làm phân tử CO$_2$ không bị phân cực trong khi sự bất đối xứng của H$_2$O làm phân tử nước bị phân cực.
### 6. Liên kết hydrogen trong sự sống
Liên kết hydrogen là một liên kết xuất hiện rất nhiều trong tự nhiên, đặc biệt là sự sống. Chúng ta biết DNA là chuỗi xoắn kép, mỗi chuỗi tạo bởi liên kết cộng hoá trị giữa các nhóm phosphate và nhóm đường. Giữa hai nhánh là các base adenine (A) - thymine (T) và guanine (G) - cytosine (C). Tương tác giữa hai nhánh của DNA là liên kết hydrogen xuất hiện giữa các base (Hình 5).
Liên kết hydrogen trong DNA có năng lượng khoảng 2-10 kJ/mol, đủ mạnh để DNA bền vững nhưng cũng đủ yếu để hai nhánh có thể bị tách ra trong các quá trình sao chép DNA hoặc phiên mã RNA.
Ngoài DNA, liên kết hydrogen còn xuất hiện giữa các amino acid để tạo ra cấu trúc bậc 3, 4 của protein, giữa các polysaccharides để tạo cấu trúc bền vững của cellulose ở thực vật, giữa enzyme với cơ chất, giữa chất dẫn truyền thần kinh và các thụ thể trên bề mặt tế bào thần kinh...
[[Bằng chứng về gene vị kỉ]]
Nguyễn Hoàng Hải
19/6/2024.
(c) CC BY-NC.